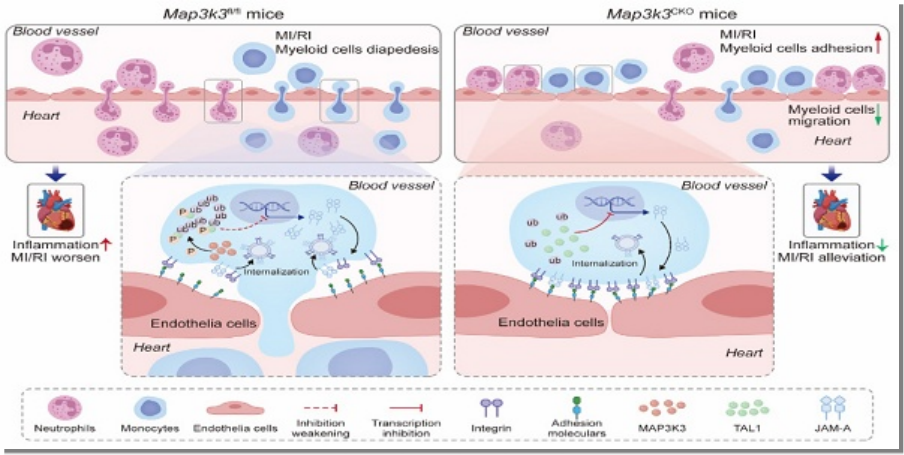
本研究揭示MAP3K3通过TAL1/JAM-A 信号通路调控髓系细胞跨内皮迁移(渗出),在心肌缺血再灌注损伤(MI/RI)中发挥关键作用:MI/RI 患者和小鼠模型中,髓系细胞的 MAP3K3 表达显著上调且与损伤严重程度正相关,髓系细胞特异性敲除 Map3K3 可通过增强 TAL1 对 F11r(编码 JAM-A)的转录抑制、减少整合素内化,降低髓系细胞渗出并减轻 MI/RI;Pazopanib(MAP3K3 抑制剂)通过阻断 MAP3K3 的磷酸化活性,抑制 TAL1 泛素化降解和 JAM-A 表达,减少髓系细胞渗出,显著改善 MI/RI,为 MI/RI 及相关炎症疾病提供了新的治疗靶点。


研究![]() 临床背景
临床背景
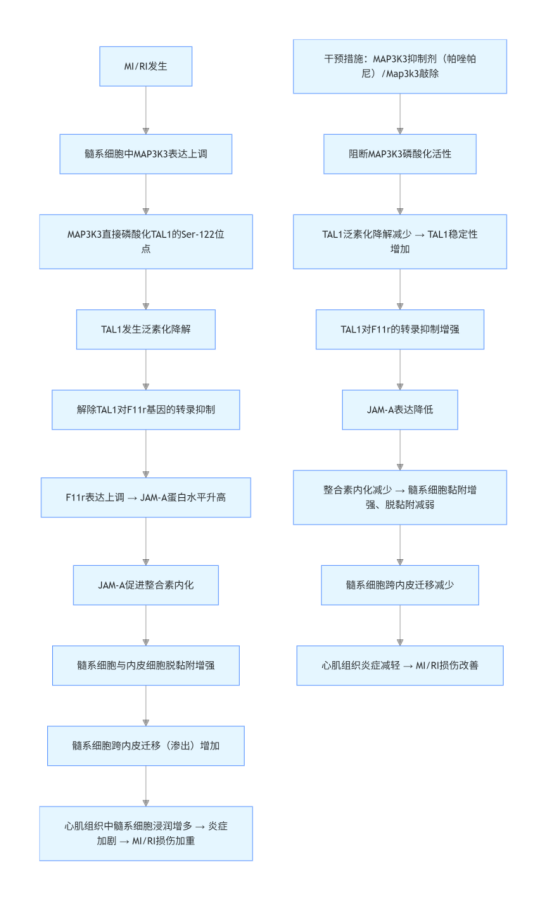
急性心肌梗死(MI)后早期血供恢复可减少心肌细胞损失,但继发性心肌缺血再灌注损伤(MI/RI)仍严重威胁心功能;髓系细胞(单核细胞、中性粒细胞)渗出是 MI/RI 炎症反应的关键步骤,通过释放促炎因子加剧心肌损伤,但该过程的上游调控通路尚未wan全明确。
核心分子
MAP3K3:丝氨酸 / 苏氨酸蛋白激酶,参与 MAPK、NF-κB 等通路,在炎症和心血管疾病中起作用,但在髓系细胞渗出中的功能未知。TAL1:转录因子,参与造血细胞生成,其在髓系细胞渗出中的作用未明确。JAM-A:由 F11r 编码,调控整合素内化和白细胞脱黏附,缺失可减少缺血再灌注损伤中的白细胞渗出。
研究目的
阐明 MAP3K3 在 MI/RI 髓系细胞渗出中的作用及分子机制,评估其作为治疗靶点的潜力。
研究类型 | 具体内容 | 关键参数 / 数量 |
临床样本研究 | MI/RI 组:66 例 ACS 患者(PCI 术后 12h,罪犯血管狭窄 > 90%);对照组:6 例冠脉造影阴性者(狭窄 < 50%) | 检测指标:外周血单核 / 中性粒细胞 MAP3K3 表达、心脏标志物(c Tn特 、CK-MB 等) |
动物模型 | 小鼠 MI/RI 模型:左前降支冠状动脉结扎 45 分钟后再灌注 | 实验动物:6-8 周龄 C57BL/6 景 Map3k3fl/fl、Map3k3CKO 小鼠,性别匹配 |
药物干预 | Pazopanib(MAP3K3 抑制剂) | 剂量:1.5mg/kg;给药时间:术后即刻、24h、48h;给药方式:腹腔注射 |
关键实验技术 | 1. 分子检测:RNA-seq、磷酸化蛋白质组学、Western blot、双荧光素酶报告基因 assay;2. 细胞功能:Transwell 渗出实验、黏附实验、流式细胞术(髓系细胞表型分析);3. 动物表型:超声心动图(LVEF/LVFS 检测)、Evans blue-TTC 染色(梗死面积)、TUNEL 染色(凋亡) | - |
结果
临床样本:MI/RI 患者外周血单核细胞、中性粒细胞中 MAP3K3 的 mRNA 和蛋白水平显著高于对照组(P<0.05),且与 CK-MB(单核 / 中性粒细胞)、LDH(单核 / 中性粒细胞)、cTn特(单核细胞)等心脏标志物正相关(r 值范围 0.3-0.5,P<0.05)。
动物模型:小鼠 MI/RI 术后,心脏髓系细胞(CD45+Ly6G + 中性粒细胞、CD45+Ly6G-CD11b+Ly6C + 单核细胞)的 MAP3K3 表达在术后 3 天达峰值,显著高于对照组(P<0.01)。
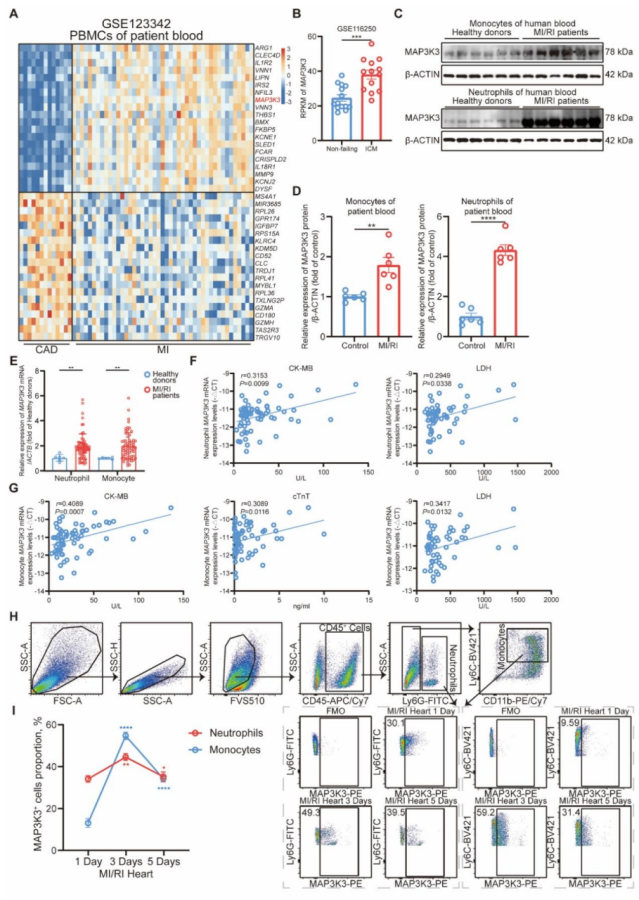
图 1 心肌缺血再灌注损伤(MI/RI)期间髓系细胞中 MAP3K3 表达上调且与心脏标志物相关。
对 GSE123342 数据集的生物信息学转录组分析,发现与稳定型冠心病(CAD)患者相比,MI 患者外周血单个核细胞(PBMCs)中 MAP3K3 表达水平显著上调。在人类缺血性心肌病(ICM)左心室组织中(GSE57338 数据集),MAP3K3 表达也呈上调趋势(图 1B)。在 MI/RI 患者的中性粒细胞和单核细胞中分别验证了 MAP3K3 的上调表达(图 1C-E)。MI/RI 患者中性粒细胞和单核细胞中 MAP3K3 表达水平与血清心脏标志物 (包括 CK-MB、cTn特、LDH、pro-BNP、CRP、白细胞介素 - 6(IL-6))及血常规指标的相关性。结果显示,中性粒细胞和单核细胞中 MAP3K3 的 mRNA 表达水平与 CK-MB、LDH 呈正相关,而单核细胞中 MAP3K3 的 mRNA 表达水平还与 cTn特 呈正相关(图 1F-G)。
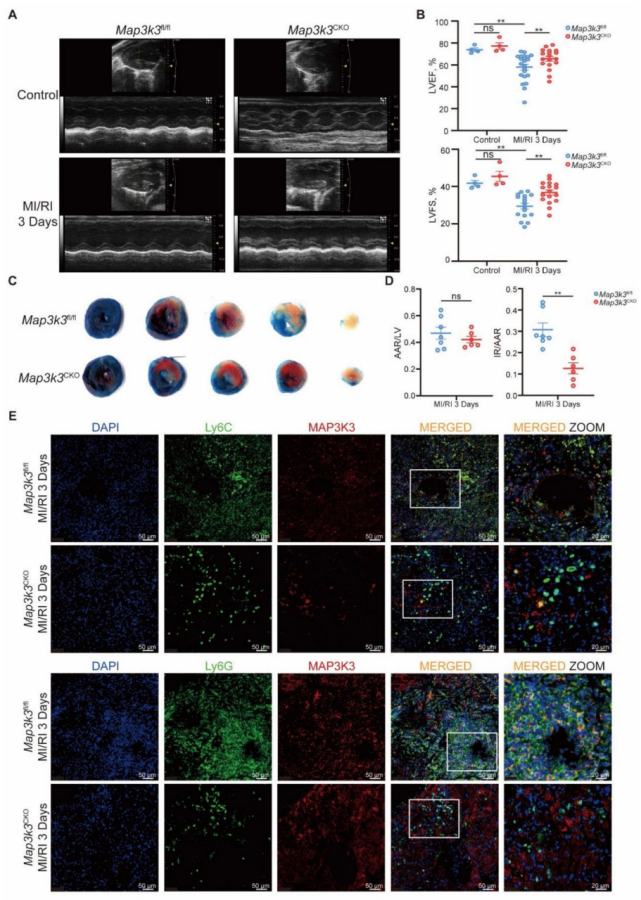
图 2 髓系细胞特异性 Map3k3 缺陷可减轻心肌缺血再灌注损伤(MI/RI)并减少髓系细胞向心脏的浸润
构建髓系细胞特异性 Map3k3 缺陷(Map3k3CKO)小鼠,并在 Map3k3CKO 小鼠和 Map3k3fl/fl 小鼠中建立 MI/RI 模型。髓系细胞中 Map3k3 缺陷可改善心脏功能,表现为左心室射血分数(LVEF)和左心室短轴缩短率(LVFS)升高(图 2A-B),且梗死面积缩小(图 2C-D)。对 MI/RI 组织切片进行免疫荧光染色,发现髓系细胞中 Map3k3 缺陷可减少心肌组织中髓系细胞的浸润(图 2E )。
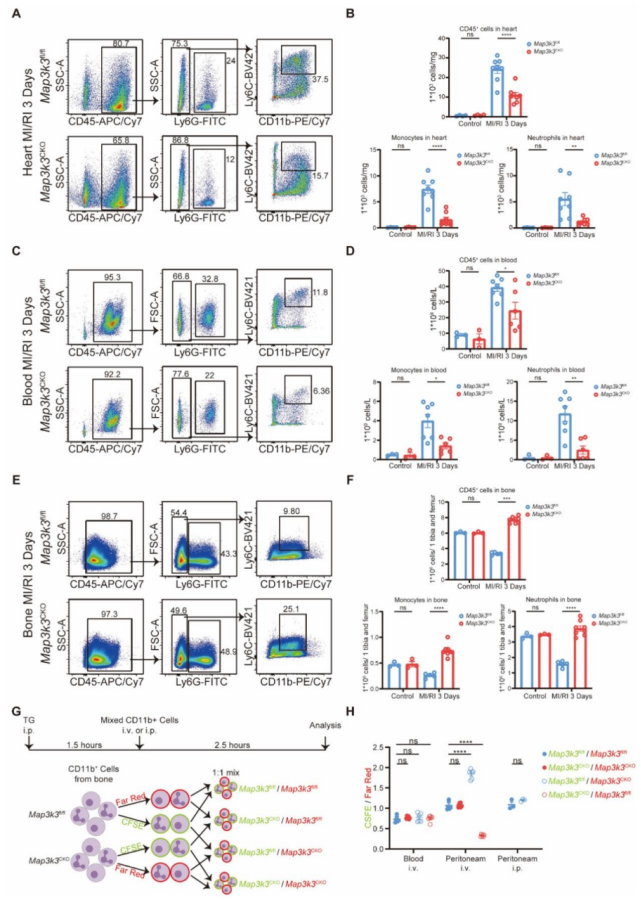
图 3 髓系细胞特异性 Map3k3 缺陷可减少心肌缺血再灌注损伤(MI/RI)后髓系细胞从骨髓的跨内皮迁移及体内跨内皮迁移过程
为进一步阐明 Map3k3 缺陷对髓系细胞迁移的影响,我们对 MI/RI 小鼠进行流式细胞术分析。结果显示,Map3k3CKO 小鼠心脏中浸润的中性粒细胞和单核细胞比例均降低(图 3A-B )。追溯髓系细胞的迁移路径发现,Map3k3CKO 小鼠血液中的中性粒细胞和单核细胞比例降低(图 3C-D ),而骨髓中的中性粒细胞和单核细胞比例升高(图 3E-F )。将来自 Map3k3CKO 小鼠或 Map3k3fl/fl 小鼠骨髓的标记髓系细胞混合物注入循环系统,2.5 小时后检测腹腔和血液中两种髓系细胞群体的比例(图 3G)。所有混合物在血液中的标记比例略有差异,证实了 1:1 的混合比例且注射过程无影响。在腹腔中,无论使用何种染料标记,Map3k3CKO 小鼠的髓系细胞比例均降低。而当髓系细胞直接注入腹腔时,两种小鼠的髓系细胞比例无显著差异(图 3H)。
![]()
心功能改善:Map3k3CKO 小鼠 MI/RI 术后 3 天的 LVEF(58.2%±2.1% vs 45.3%±1.8%)和 LVFS(30.1%±1.2% vs 22.5%±1.0%)显著高于 Map3k3fl/fl 小鼠(P<0.01)。
损伤减轻:梗死面积(IR/AAR)从 Map3k3fl/fl 小鼠的 45.2%±3.1% 降至 Map3k3CKO 小鼠的 28.6%±2.5%(P<0.01),心肌细胞凋亡率(TUNEL 阳性率)降低 35%±4%(P<0.01)。
渗出抑制:Map3k3CKO 小鼠心脏中髓系细胞浸润比例降低 40%±5%(P<0.01),血液中髓系细胞比例降低 25%±3%(P<0.05),骨髓中髓系细胞比例升高 30%±4%(P<0.01),提示髓系细胞从骨髓到血液的渗出受阻。
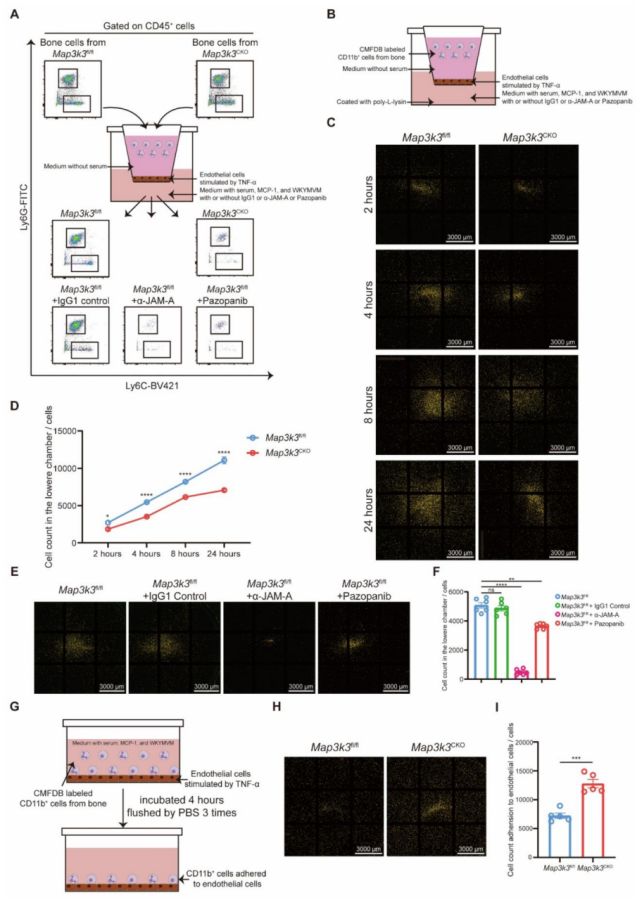
图4 髓系细胞特异性 Map3k3 缺陷可增强 TAL1 对 F11r 的转录抑制功能
测序结果显示,Map3k3CKO 小鼠中,多种黏附相关基因(如 Itgb3、Adgre4、Itgax)表达上调,而脱黏附基因 F11r 表达下调(图 4A-B)。黏附与迁移通路的基因本体(GO)分析显示,Map3k3CKO 小鼠中黏附相关术语的基因富集度升高,迁移相关基因的富集度降低(图 4C)。KEGG通路 “细胞黏附分子"(mmu04514)的基因分析显示,Itgb3 和 Itgax 表达上调,F11r 表达下调(图 4D)。由于 F11r 的表达变化发生在 RNA 水平,我们追溯其转录因子,鉴定出四个可能参与 F11r 转录调控的候选转录因子:TAL1、PRDM1、PPARG 和 PBX1(图 4E)。在四个候选转录因子中,仅 TAL1 在 Map3k3CKO 细胞中的磷酸化水平降低,且特异性发生在 S122 和 S172 位点(图 4F)。双荧光素酶报告基因实验显示,TAL1 主要抑制 F11r 的转录(图 4G。在 MI/RI 小鼠血液的髓系细胞中观察到 MAP3K3 和 JAM-A 表达升高,而 TAL1 表达受到抑制(图 )。在 Map3k3CKO 小鼠中,上述表达模式发生逆转(图 4I )。体外实验中,单核细胞趋化因子 MCP-1 刺激骨髓髓系细胞后,MAP3K3 和 JAM-A 表达升高,TAL1 表达降低;而 Map3k3CKO 小鼠的细胞或经帕唑帕尼(MAP3K3 激酶抑制剂 )处理的细胞中,TAL1 表达升高,JAM-A 表达受到抑制(图 4J)。在 293T 细胞中(图 4K),过表达 TAL1 可逆转 MAP3K3 过表达介导的 JAM-A 上调(图 4L );而敲低 TAL1 可逆转 Map3k3 敲除或帕唑帕尼处理介导的 JAM-A 下调(图 4M-N )。反向实验证实,MAP3K3 通过下调其抑制性转录因子 TAL1,上调 F11r 的表达。由于帕唑帕尼与 Map3k3 敲除具有相似的作用效果,该机制可能依赖于 MAP3K3 的激酶活性。
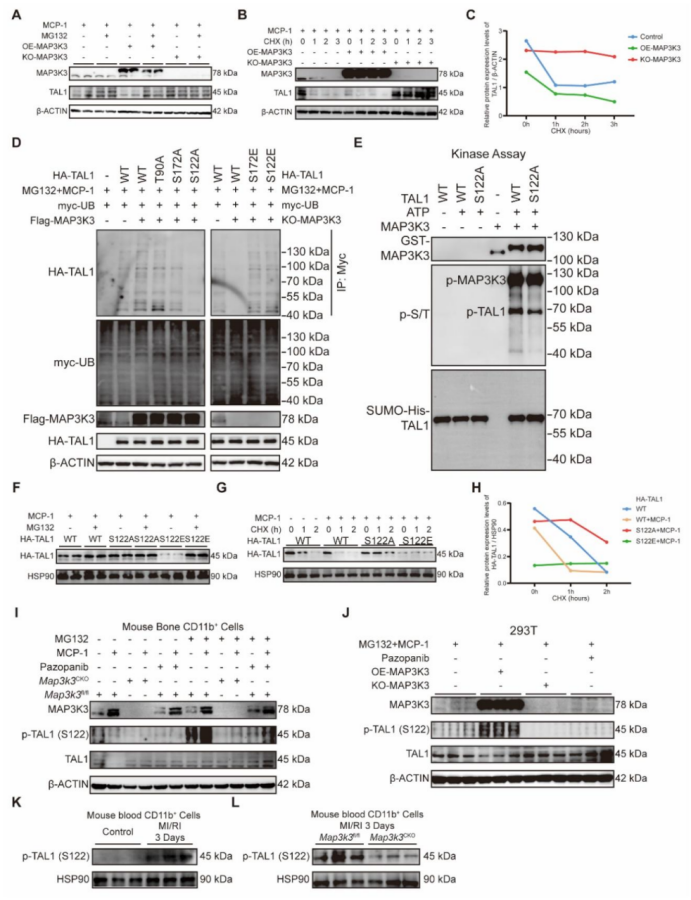
图 5 Map3k3 缺陷通过 JAM-A 以磷酸化依赖的方式增强髓系细胞黏附并减少跨内皮迁移
与 Map3k3fl/fl 小鼠的髓系细胞相比,Map3k3CKO 小鼠的髓系细胞在整个时间进程中的迁移功能均受损(图 5A-D)。同时,与未处理或 IgG1 处理的细胞相比,经 JAM-A 抗体或帕唑帕尼处理的细胞迁移能力也降低(图 5A、E-F)。然而,在黏附实验中,Map3k3CKO 小鼠的髓系细胞黏附能力增强(图 5G-I)。
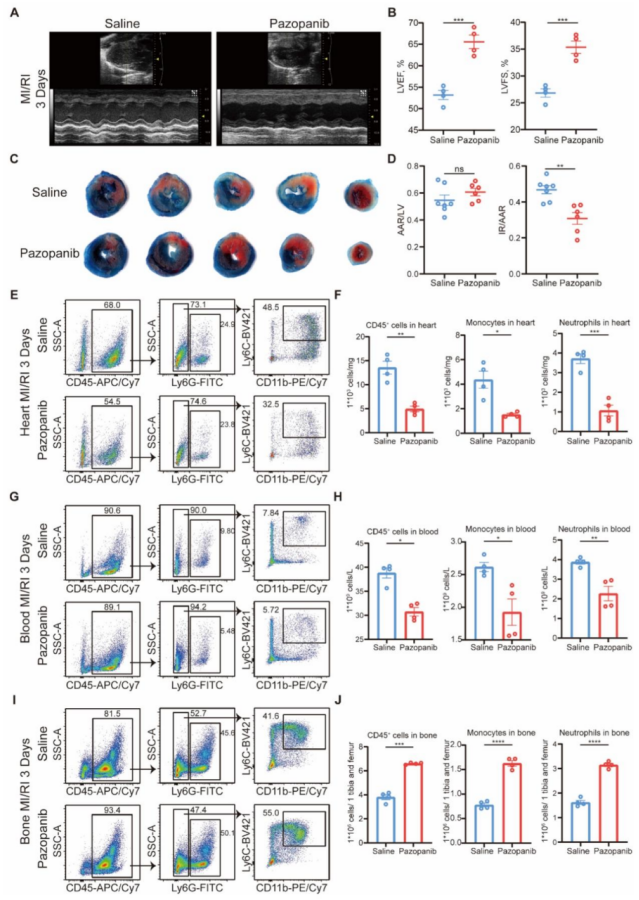
图 6 MAP3K3 通过在丝氨酸 122(Ser-122)位点磷酸化 TAL1,诱导其蛋白酶体依赖的降解
蛋白酶体抑制剂 MG132 可有效减少 MAP3K3 过表达介导的 TAL1 降解(图 6A);而使用环己酰亚胺(CHX)抑制蛋白合成后发现,MAP3K3 过表达可加速 TAL1 蛋白降解,Map3k3 敲除可增加 TAL1 蛋白稳定性(图 6B-C)。这些结果表明,MAP3K3 通过诱导 TAL1 的蛋白酶体依赖降解来减少 TAL1 的表达。MAP3K3 过表达可增加泛磷酸化抗体检测到的 TAL1 磷酸化水平,并促进 TAL1 的泛素化;T90A 突变对 TAL1 的磷酸化和泛素化无显著影响,而 S172A 突变和 S122A 突变可显著降低 TAL1 的磷酸化和泛素化水平。我们进一步将 Ser-122 或 Ser-172 位点突变为谷氨酸(E)以模拟磷酸化状态,发现 Map3k3 敲除可降低 TAL1 的磷酸化和泛素化水平,而 S122E 或 S172E 突变可维持 TAL1 的泛素化水平(图 6D)。为明确 MAP3K3 对 TAL1 的直接磷酸化作用,我们进行了体外激酶实验,发现 MAP3K3 可直接磷酸化 TAL1 的 Ser-122 位点(图 6E)。S122A 突变可减少 TAL1 的降解,而 S122E 突变可加速 TAL1 的降解,且这种加速降解可被 MG132 逆转(图 6F)。使用 CHX 抑制蛋白合成后发现,S122E 突变可加速 TAL1 蛋白降解,而 S122A 突变可增加 TAL1 蛋白稳定性(图 6G-H)。Map3k3CKO 小鼠的细胞或经帕唑帕尼处理的细胞中,TAL1 的磷酸化水平降低,稳定性增加(图 6I)。在 293T 细胞系中也观察到了相同的现象(图 6J)。在 MI/RI 小鼠血液的髓系细胞中,p-TAL1(S122)的表达水平升高(图 6K);而在 Map3k3CKO 小鼠中,该表达模式发生逆转(图 6L)。
![]()
![]()
心功能与损伤:Pazopanib 处理组小鼠的 LVEF(56.8%±2.0% vs 44.9%±1.9%)、LVFS(29.5%±1.1% vs 22.3%±1.1%)显著高于生理盐水组(P<0.01),梗死面积(IR/AAR)从 44.8%±3.0% 降至 30.2%±2.6%(P<0.01)。
渗出抑制:Pazopanib 处理后,心脏、血液中髓系细胞比例分别降低 38%±4%、23%±3%(P<0.01),骨髓中髓系细胞比例升高 28%±3%(P<0.01),与 Map3k3CKO 小鼠表型一致。
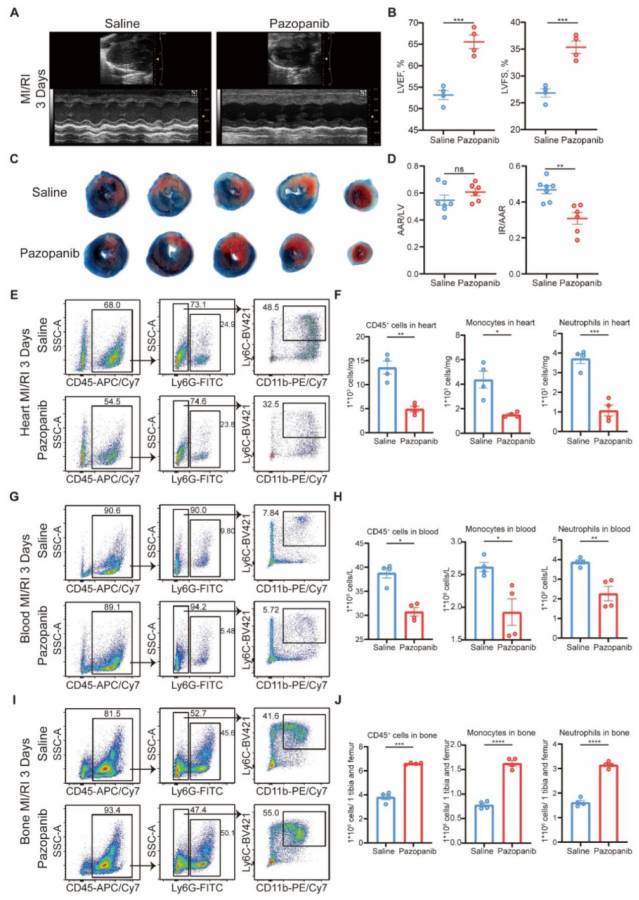
图 7 帕唑帕尼通过降低 MAP3K3 的磷酸化活性及髓系细胞从骨髓的跨内皮迁移,改善心肌缺血再灌注损伤(MI/RI)
帕唑帕尼治疗可改善 MI/RI,表现为 LVEF 和 LVFS 升高(图 7A-B)、梗死面积缩小(图 7C-D)以及 TUNEL 染色显示的心肌细胞凋亡减少。对 MI/RI 小鼠的流式细胞术分析显示,帕唑帕尼治疗可减少中性粒细胞和单核细胞从骨髓向心脏(图 7E-F)和血液(图 7G-H)的迁移(图 7I-J)。
研究结论与意义
核心结论:MAP3K3 通过磷酸化 TAL1(Ser-122)促进其泛素化降解,解除对 F11r 的转录抑制,上调 JAM-A 表达,增强整合素内化,最终促进髓系细胞脱黏附和渗出,加剧 MI/RI。
临床意义:Pazopanib(低剂量、短期给药)可通过抑制 MAP3K3 活性,阻断上述通路,减少髓系细胞渗出,为 MI/RI 及其他炎症相关疾病(如脓毒症)提供了新的治疗策略。